ADENOVIRUS R-GENE®
Un kit de PCR en tiempo real para la detección y cuantificación de ADN de ADENOVIRUS
- Una cuantificación precisa de carga viral de ADENOVIRUS con una amplio rango lineal
- Detección de todos los serotipos conocidos
- Kit listo para su uso que incluye control interno y estándares de cuantificación
- Validado CE-IVD en múltiples tipos de muestras y en todas las principales plataformas de extracción y sistemas PCR en tiempo real
Necesita más información
Ventajas de ADENOVIRUS R-GENE®
La infección por ADENOVIRUS resulta una complicación grave para pacientes inmunocomprometidos, que ocasiona altos niveles de morbilidad y mortalidad. La detección y la monitorización optimizadas de una infección por ADENOVIRUS es por tanto muy importante para mejorar el manejo del paciente. Al aportar la detección y/o cuantificación del genoma de todos los serotipos de ADENOVIRUS conocidos, ADENOVIRUS R-GENE® es una solución ideal. Ofrece una detección rápida y específica para ayudarle a seguir el curso de la infección y monitorizar la respuesta al tratamiento. Para mejorar aún más la optimización de las pruebas, la gama R-GENE® le permite cuantificar varios virus en la misma muestra a la vez, o analizar varias muestras distintas en la misma serie.
- Sensible y reproducible
- Medida fiable de la infección por ADENOVIRUS
- Amplio rango lineal
- Estandarizado
- Perfiles de tests armonizados para realizar múltiples ensayos a la vez
- Procesado uniforme de la gama de productos R-GENE® (CMV R-GENE®, HSV1 HSV2 VZV R-GENE®, CMV HHV6,7,8 R-GENE®, BK Virus R-GENE®, EBV R-GENE®, PARVOVIRUS B19 R-GENE®, BORDETELLA R-GENE®)
- Flexible
- Validado para el uso con múltiples tipos de muestras
- Cualificado para uso manual o con sistemas de preparación de muestra automatizados como NUCLISENS® EASYMAG®, NUCLISENS® EMAG® y plataformas de preparación de ensayos como ESTREAM®
- Validado para las principales plataformas de PCR en tiempo real
Kit completo con todo lo que necesita
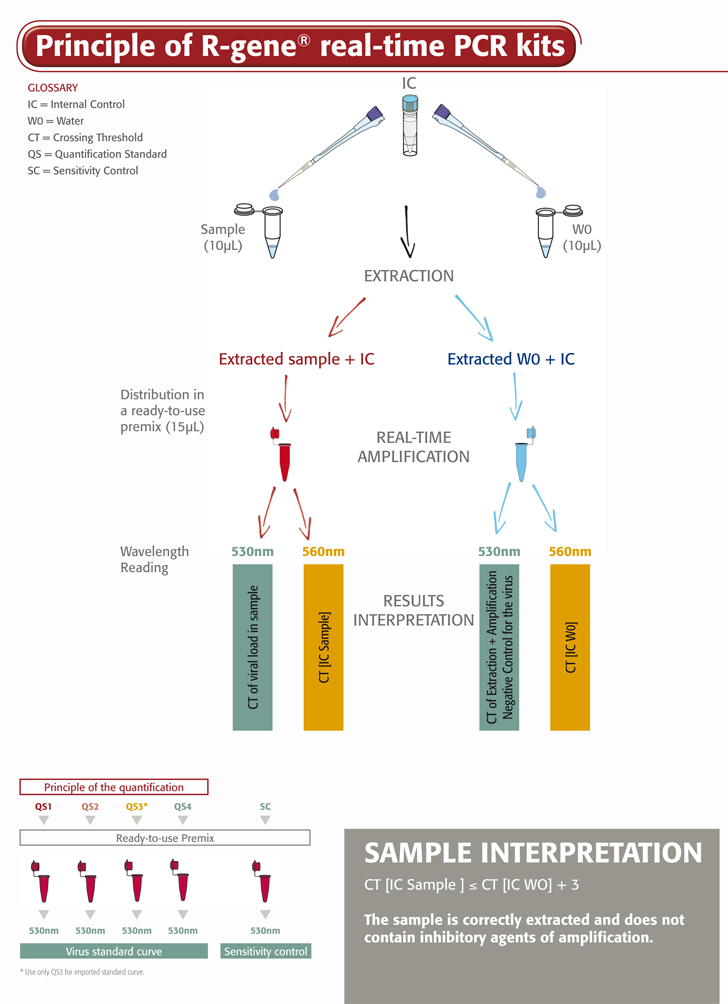
El kit ADENOVIRUS R-GENE® kit es un ensayo molecular listo para su uso diseñado para detectar y cuantificar la carga vírica del ADENOVIRUS mediante PCR en tiempo real, tras la extracción del ADN vírico. Esta tecnología, basada en Taqman nucleasa-5, amplifica y detecta simultáneamente una región específica del genoma vírico.
- Cuatro estándares de cuantificación garantizan una medida precisa de la carga viral de ADENOVIRUS
- El control de sensibilidad valida el rendimiento del ensayo en la rutina del laboratorio
- El control interno (IC2) comprueba el proceso de extracción, incluyendo la lisis y la presencia de inhibidores de amplificación en la muestra
- Incluye todos los reactivos necesarios optimizados para detectar y cuantificar el ADENOVIRUS. Para uso en diagnóstico in vitro
Procedimiento sencillo
El kit ADENOVIRUS R-GENE® es fácil de usar. Sólo hace falta añadir la muestra de ADN extraída a la master mix de PCR lista para su uso y empezar la reacción del termociclador PCR en tiempo real, siguiendo un programa de ciclado optimizado descrito en las "Instrucciones de uso".
BIOMERIEUX, el logo azul, ARGENE®,R-GENE®, EASYMAG® y NUCLISENS®, se emplean, dependen y/o son marcas registradas pertenecientes a bioMérieux S.A. o a cualquiera de sus filiales o de sus empresas.
Cualquier otro nombre o marca registrada es propiedad de su respectivo propietario.
|
ADENOVIRUS R-GENE® (69-010B) |
|
|---|---|
|
Principio de la prueba |
Detección genómica y cuantificación de ADENOVIRUS |
|
Información de pedido |
Referencia 69-010B |
|
Tecnología |
PCR en tiempo real / Tecnología Taqman nucleasa-5' |
|
Diana génica |
Exón del genoma de ADENOVIRUS |
|
Espécimen* |
Sangre total, plasma, LCR, heces, biopsias, especímenes oculares, muestras respiratorias (aspirados nasofaríngeos, BAL, hisopos nasales) |
|
Límite de detección |
Sangre total: 8 copias/PCR (200 copias/ mL) Espécimen nasal: 10 copias/PCR (261 copias/ mL) Sangre total: 550 copias/mL Secreciones nasales: 670 copias/mL |
|
Rango dinámico de cuantificación |
Sangre total: 2,58 103 copias/mL a 4,65 1010 copias/mL Muestra nasofaríngea: 5,19 103 copias/mL a 8,25 1010 copias/mL Hasta 5x106 copias/ mL |
|
Controles incluidos |
Extracción + Control de inhibición, control de sensibilidad, control negativo |
|
Resultados en |
75 minutos (paso de extracción no incluido) |
|
Unidad de comunicación |
Copias/mL |
|
Número de tests |
90 tests |
|
Condiciones de almacenamiento |
-18°C/-22°C |
|
Plataformas validadas de extracción* Manual / Automatizada |
QIAamp DNA Blood Mini kit QIAamp DNA Stool Mini kit QIAcube NUCLISENS® EASYMAG® QIAsymphony MagNA Pure LC MagNA Pure Compact MagNA Pure 96 Biorobot M48 m2000sp VERSANT kPCR Molecular System SP |
|
Plataformas validadas de amplificación* |
Life Technologies (ABI7500, ABI7500 Fast & StepOne) LightCycler 1.0 LightCycler 2.0 LightCycler 480 II SmartCycler 2.0 RotorGene VERSANT kPCR Molecular System AD Biorad DX Real-Time system Stratagene / Agilent |
|
Estado |
Para uso en diagnóstico in vitro, marcado CE en Europa |
* por favor consulte
Datos rápidos sobre ADENOVIRUS
¿Qué es el ADENOVIRUS ?
Los ADENOVIRUS son virus icosaédricos no encapsulados, de ADN bicatenario de medio tamaño. Al menos se han descrito siete especies de ADENOVIRUS en humanos (A-G), incluyendo 52 serotipos. Los ADENOVIRUS pueden causar enfermedades respiratorias, oculares o gastrointestinales principalmente tanto en niños y militares como infecciones endémicas o brotes. Las infecciones por ADENOVIRUS son comunes y suelen ocurrir a lo largo del año, en todo el mundo.
¿Quién tiene mayores riesgos?
En los últimos años, los ADENOVIRUS se han reconocido como patógenos víricos significativos con alta mortalidad y morbilidad entre pacientes inmunocomprometidos. Las manifestaciones clínicas en pacientes inmunocomprometidos incluyen neumonía, hepatitis, cistitis hemorrágica, colitis, pancreatitis, meningoencefalitis, y enfermedad diseminada, dependiendo de la enfermedad subyacente, del sistema orgánico afectado, de la edad del paciente y del serotipo del virus.
¿Cuáles son los beneficios del testeo del ADENOVIRUS?
Los ensayos basados en PCR en tiempo real permiten una detección rápida y específica antes de que los síntomas clínicos aparezcan, para ayudar a mejorar el manejo del paciente, que resulta especialmente importante para pacientes inmunocomprometidos, que pueden verse gravemente afectados. Las pruebas ayudan a seguir la efectividad de un tratamiento activo y pueden usarse para monitorizar una recaída tras el tratamiento.
ADENOVIRUS R-GENE®: PUBLICACIONES
- Comparison of the EZ1 XL advanced and the Magna Pure instruments for the extraction of whole blood before DNA quantification of CMV, EBV, HHV 6 and ADENOVIRUS
Marie Gueudin, Alexandre Louvel, Jean-Christophe Plantier, Laboratoire de virologie, CHU de Rouen, Université de Rouen, France. ECV 2013 - Comparison of in-house real-time quantitative PCR to the ADENOVIRUS R-GENE kit for determination of adenovirus load in clinical samples.
Jeulin et al. Laboratory of Virology, Nancy University Hospital, France. J Clin Microbiol. 2010 Sep;48(9):3132-7. Epub 2010 Jul 14. - ADENOVIRUSES in Immunocompromised Hosts
Echavarria. Laboratory of Clinical Virology, University Hospital, Buenos Aires. Clinical Microbiology Reviews, Oct 2008, 704-715 - Analytical and Clinical Evaluation of the ARGENE ADENOVIRUS R-GENE Assay.
Malgorzata Kowerska et al. Department of Pathology and Laboratory Medicine, North Shore-LIJ Health System Laboratories, NY. CVS 2011 - Prognostic value of qPCR for ADENOVIRUS detection in stool samples compared with antigen detection and cell culture in hematopoietic cell transplant recipients and evaluation of ADENOVIRUS R-GENE™ kit
Jeulin et al. Laboratory of Virology, Nancy University Hospital, France. CVS 2010 - Outbreak of ADENOVIRUS keratoconjuntivitis in health care workers : coinfection with different ADENOVIRUS species.
Echavarria et al. Laboratory of Clinical Virology, University Hospital, Buenos Aires. CVS 2009 - Development of a new diagnostic tool for the quantification of ADENOVIRUS by Real Time PCR.
Magro et al. ARGENE. ESCV 2010 - A commercial Real Time PCR for ADENOVIRUS
Echavarria et al. Laboratory of Clinical Virology, University Hospital, Buenos Aires. ESCV 2009 - Validation of commercial (ARGENE) FLU A/B, RSV A/B and ADENOVIRUS PCR assay.
Hocker et al. Scott&White Hospital/Texas A&M Health Science Center College of Medicine, Temple, Texas, USA. CVS 2009 - Detection of ADENOVIRUS DNA from Clinical specimens using commercial Real Time PCR reagents.
Zheng et al. Children's Memorial Hospital, Northwestern University, Chicago, Illinois. - Real-time PCR for the detection of respiratory viruses.
Seffar et al. Molecular Diagnostic Center, Laboratory of Virology, Erasme Hospital, Brussel, Belgium. ESCV 2009 - H.JEULIN, A.SALMON, P.BORDIGONI and V.VENARD
Comparaison of In-house Real-Time Quantitative PCR to the ADENOVIRUS R-GENE Kit for Determination of Adenovirus Load in Clinical Samples
Journal of Clinical Microbiology, Sept.2010.p.3132-3137 - TATE JE, BUNNING ML, LOTT L, LU X, SU J, METZGAR D., BROSCH L., PANOZZO CA, MARCONI VC, FAIX DJ, PRILL M, JOHNSON B, ERDMAN DD, FONSECA V, ANDERSON LJ, WIDDOWSON MA
Outbreak of Severe Respiratory Disease Associated with Emergent Human ADENOVIRUS Serotype 14 at a US Air Force training Facility in 2007.
J Infect Dis. 15;199(10):1419-1426, May 2009 - ECHAVARRIA M.
ADENOVIRUS in immuno compromised Host. Clinical Microbiology reviews, Oct 2008, p.704-715. - VABRET A., GOUARIN S., JOANNES M., BARRANGER C., PETITJEAN J., CORBET S., BROUARD J., DUHAMEL JF., GUILLOIS B. AND FREYMUTH F.
Development of a PCR and hybridization-based assay (PCR ADENOVIRUS CONSENSUS) for the detection and the species identification of ADENOVIRUS in repiratory specimens.
J.Clin virology 31(2):116-22, Oct 2004. - HEIM A., EBNET C., HARSTE G., PRING-AKERBLON P.
Rapid and Quantitative Detection of Human ADENOVIRUS DNA by Real-Time PCR.
Journal of Medical Virology 70: 228-239, 2003.